Ензимите са биологични катализатори (ускорители на химични процеси), за които са валидни всички общи свойства на катализаторите. Отличават се от тях по изключително високата си ефективност, специфичност (субстратна и реакционна) и възможността за регулация на активността и синтезата им. Ензимите са високоспециализирани белтъчни молекули, които биват еднокомпонентни (съдържащи само белтъчна част) и двукомпонентни (съдържащи белтъчна и небелтъчна част ). Ако връзката между двете съставни части е слаба, небелтъчната част се нарича коензим, ако връзката между двете части е здрава, ковалентна – небелтъчната част се определя като простетична група.
Броят на ензимите, участващи в осъществяване на метаболизма на човешката клетка надвишава 3 000. Те са разпределени в 6 главни групи.
Тези групи са:
- оксидоредуктази
- трансферази
- хидролази
- лиази
- изомерази
- синтетази
Името на всеки ензим има (съдържа) две части: например сукцинат дехидрогеназа. Първата част дава името на субстрата, а втората посочва типа на катализираната реакция. Всеки ензим има кодов номер, състоящ се от четири цифри. Първата дава типа на реакцията (главната група); втората и третата цифри дават допълнителна информация за характера и механизма на реакцията (определят подгрупата и подподгрупата). Четвъртата цифра е индивидуалният номер на ензима.
Активният център е малка част по повърхността на ензимната молекула, където се свързва субстрата, за да се превърне в краен продукт. В еднокомпонентните ензими активния център се състои от няколко отдалечени по протежение на веригата аминокиселинни остатъци, които са близко в пространството поради формираната третична структура на белтъчната молекула.
От функционална гледна точка различните химични групи в активния център се определят като каталитични и контактни. В двукомпонентните ензими за формиране на активния център
групи предоставя и небелтъчната съставка.
Свойства на ензимите
Специфичността, реакционна и субстратна, е едно от най-съществените свойства на ензимите. Реакционната специфичност се определя от възможностите на групите в активния център да образуват или разграждат определен тип химични връзки. Субстратната специфичност се обяснява с високите стерични изисквания на активния център спрямо субстрата, произтичащи от определена ензимна конформация. Има различни модели за обяснение на субстратната специфичност:
- на Фишер (абсолютно структурно и геометрично съответствие между активния център и субстрата), валиден за малък брой абсолютно специфични ензими
- на Кошланд (индуцирано структурно притъкмяване плюс субстратно напрежение), валиден за повечето ензими. Стереоспецифичността се обяснява с множествено свързване на субстрата към активния център
Значение на ензимите
Учението за ензимите е основа на нашите познания върху всеки жизнен процес в норма и патология. Всеки физиологичен процес протича благодарение на каталитичното действие на определени ензими. Много заболявания непосредствено възникват от нарушения в ензимната катализа. Определянето на ензимни активности в кръв и други биологични течности дава ценни сведения за медицинската диагностика. Ензими се използват и за терапия при някои заболявания, наприме инфаркт на миокарда. Поради това изучаването на особеностите на ензимите и на катализираните от тях реакции е рационален и съвременен подход в медицината.
Oбщи свойства на ензимите като катализатори
Ензимите са биокатализатори, ускоряващи определени химични реакции в клетката. Болшинството от ензимите са белтъци, предимно глобуларни. Отскоро се знае, че малка част от РНК, наречени рибозими, също действат като биокатализатори.
За ензимите са валидни всички общи свойства на катализаторите:
1) увеличават скоростта на спонтанно протичащи реакции, без да изместват химичното равновесие
2) променят в еднаква степен скоростта на правата и на обратната реакция до достигане на химично равновесие
3) действат в незначителни количества
4) понижават активиращата енергия на реакцията
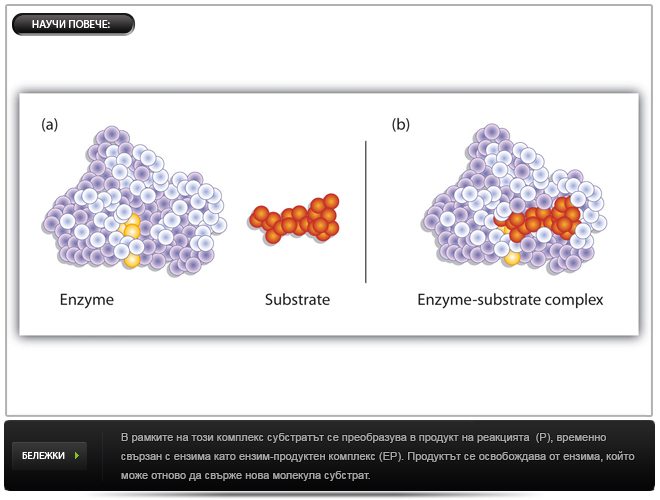
Ензимите, както и другите катализатори, снижават активиращата енергия, защото провеждат реакцията по друг път с по-ниски енергетични изисквания. Характерно е образуването на междинно съединение между изходното вещество (т.н. субстрат) и ензима, което се нарича ензим-субстратен комплекс. Възможно е да се образуват няколко междинни съединения. Независимо колко са междинните фази, активиращата им енергия е винаги по-ниска от тази за некатализираната реакция.
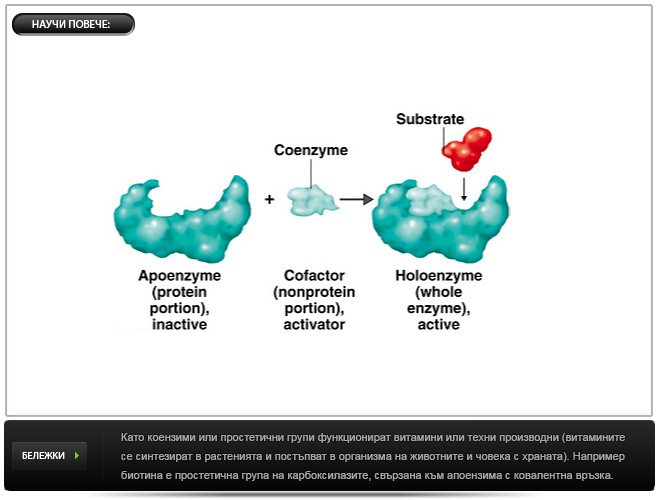
Коензими и простетични групи
Освен еднокомпонентни, има и двукомпонентни ензими, които съдържат белтъчна съставка (апоензим) и небелтъчна съставка. Апоензимът е термолабилен, високомолекулен и не диализира през полупропускливи мембрани. Небелтъчната съставка е термостабилно, нискомолекулно вещество, което диализира през полупропускливи мембрани. Двукомпонентният ензим се означава като холоензим.
Други примери: пиридоксалфосфат и пиридоксаминфосфат, близки производни на витамин В6 (пиридоксол), са коензим на трансаминази. Метални йони и фосфатни остатъци често също така действат като простетични групи и т.н.
От химична гледна точка част от коензимите са нуклеотиди – например АТФ (аденозин трифосфат) е преносител на фосфатна група и енергия. Други нуклеотидни коензими са едновременно и производни на витамини – например никотинамидаденин динуклеотид (НАД), пренасящ водород, е динуклеотид, който съдържа аденилов нуклеотид и друг нуклеотид с никотинамидна база. Последната е всъщност витамин РР. Подобен е случаят и с други Н-пренасящи коензими като флавинмононуклеотид (ФМН) и флавинадениндинуклеотид (ФАД). ФМН и ФАД съдържат базата рибофлавин (витамин В2).
Представа за механизъм на ензимната катализа
Въпреки че в края на реакцията eнзимите като катализатори се възстановяват непроменени, те фактически участват активно в хода на реакцията – образуват със субстрата (S) междинен ензимно-субстратен комплекс (ЕS). ES комплекси са много нестабилни, имат къс живот, трудно се изолират и изучават. Не при всички ензимни белтъци се знае детайлната пространствена организация, което също затруднява изучаването на ES комплекси. Но има доказателства, че те наистина възникват:
- промяна в спектъра на ензима при взаимодействие със субстрата – например при пероксидаза с простетична група хем
- чрез рентгеноструктурен анализ са получени преки доказателства за образуване на ES комплекси
- изолиранe на комплекси между ензим и инхибитор, който е структурен аналог на субстрата. Тези комплекси са по-стабилни и по-лесно се изолират
В най-общ вид ензимно-катализираната реакция протича по следния начин:
Е + S ––-> ES ––-> EP –––> E + P
Всеки от трите съставни процеса притежава своя активираща енергия, по-ниска от енергията на некатализирания процес. Активиращата енергия може да се понижи по четири различни механизма:
- киселинно-основна катализа (например при рибонуклеаза)
- индуциране на напрежение в субстратната молекула (например при лизозим)
- ковалентна катализа (например при серинови протеази)
- ентропийни ефекти
Често ензимните реакции са от смесен тип. Например при лизозим се наблюдава комбинация от първите два механизма. При реакциите, в които участва повече от един субстрат, или пък като втори субстрат действа някакъв коензим, реакцията протича по два главни механизма:
- т.н. „пинг-понг“-механизъм (например при трансаминиране)
- последователен механизъм, като редът на свързването на субстратите може да бъде случаен или определен
Какво е активен център?
Ензимът взаимодейства със субстрата, чрез своя активен център. Активният център е неголям участък по повърхността на ензимната молекула, където субстратът се свързва и се превръща в продукт. В еднокомпонентни ензими активният център се състои от няколко аминокиселинни остатъка, които са отдалечени по протежение на полипептидната верига, но са близко разположени в пространството поради формиране на третична структура на белтъка. Например в активния център на химотрипсина участват Хис57, Асп102 и Сер195.
От химична гледна точка групите в активния център могат да бъдат най-различни -SH, -NH2, -ОН, имидазолово ядро и прочие. От функционална гледна точка, според Кошланд се различават 2 вида групи, участващи в активния център:
1) каталитични (вземат пряко участие в реакциите на превръщане на субстрата в продукт).
2) контактни (прикрепват субстрата към активния център така, че атакуемата от ензима връзка да попадне в обсега на действие на каталитичните групи).
В случаите, когато катализираната реакция изисква включването на две или повече различни субстратни молекули, контактните групи ги довеждат до най-благоприятна за реагиране позиция. Така контактните групи съдействат най-много за високата скорост на ензимно катализираните реакции.
Реакционна специфичност
Реакционната специфичност се определя от възможностите на включените в активния център аминокиселинни остатъци да образуват или разграждат определен тип химични връзки. Пример: три различни ензимa аминоацидооксидази (E1), трансаминази (Е2) и декарбоксилази (Е3) превръщат един и същи субстрат (аминокиселини) в три различни процеса до различни продукти.
Субстратна специфичност
Субстратната специфичност се обяснява с високите изисквания на активния център спрямо субстрата, произтичащи от определена ензимна конформация. Чрез пространствената организация на ензима се създава много добро химично и структурно съответствие на контактните и каталитичните групи в активния център към съответните групи от субстрата. Молекулните размери и разположението на йонни групи и хидрофобни участъци в ензима осигуряват възможност за свързване на определен, понякога единствен субстрат. Други ензими проявяват известна толерантност и могат да въздействат на няколко близки по структура субстрати. Например хексокиназата катализира фосфорилирането на глюкоза, фруктоза, маноза, глюкозамин и 2-дезоксиглюкоза, но с различна скорост.
Съществуват различни модели за обясняване на субстратната специфичност на ензимите. Според модела на Фишер съществува априори абсолютно структурно и геометрично съответствие между активния център и субстратната молекула, така както е съответствието между секретна брава и ключ. Водородни, йонни връзки и хидрофобни взаимодействия допринасят за свързването между ензима и субстрата. Този модел добре обяснява абсолютната субстратна специфичност при малък брой ензими – например уреаза, аргиназа, сукцинат дехидрогеназа, амино-ацил-тРНК синтетази.
Изследвани са стотици съединения и резултатът е все един и същ – уреазата има един единствен субстрат. Абсолютната специфичност на амино-ацил-тРНК синтетазите осигурява недопускане на грешки при белтъчната биосинтеза.
- абсолютно структурно и химическо съответствие от типа „ключ-ключалка“ (Фишер)
- индуцирано структурно притъкмяване (Кошланд)
- индуцирано структурно притъкмяване плюс субстратно напрежение (Кошланд)
Моделът на Фишер не може да обясни всички случаи на взаимодействие между ензима и субстрата. Според Кошланд, активният център и субстрата не съвпадат напълно. Взаимодействието на ензима и субстрата предизвиква конформационни промени в свързващото място, което се променя – увеличава се афинитетът към субстрата, преориентират се някои групи и се оформя каталитичният активен център. Това е т. н. модел за индуцираното структурно притъкмяване между ензима и субстрата.
Пример за подобни промени дава ензимът хексокиназа, която придвижва един от домените си, за да обгърне глюкозата и да доближи групите от активния център до субстрата. Най-голям брой експериментални наблюдения подкрепят модела, който е съчетание от индуцирано структурно притъкмяване и субстратно напрежение. За да се осъществи реакцията, е необходимо да настъпят, макар и незначителни, конформационни изменения и в активния център, и в субстратната молекула. Необходимо е стерично донагласяне на реагиращите структури и в резултат се получава напрягане и отслабване на атакуваните връзки. Например при свързване на субстрата от ензима лизозим, са доказани конформационни промени в част от субстратната молекула (хексозен пръстен преминава от стабилна „стол“ в нестабилна „полу-стол“-конформация).
Вижте и още повече конкретно по темата за храносмилателните ензими.
Обратно към радел „Анатомия и физиология“.








4 Коментара